|
УДК 577.112.853 (048.8)
С. М. Бычков. С. А. Кузьмина
БИОЛОГИЧЕСКАЯ РОЛЬ ГИАЛУРОНОВОЙ КИСЛОТЫ (ОБЗОР)
НИЛ биологических структур Минздрава СССР. Москва
Гиалуроновая кислота (ГУК), открытая 50 лет назад в стекловидном теле глаза млекопитающих [1, 71 - 73]. присутствует вместе с другими протеогликанами в клетках и межклеточных пространствах всех тканей позвоночных [8].
ГУК является высокополимерным неразветвленным гликозаминогликаном, построенным из N-ацетил-?-D-глюкозамина и ?-D-глюкуроновой кислоты, соединенных между собой 1>3 и 1>4 гикозидными связями соответственно. В высокоочищенных препаратах ГУК, выделенных из синовиальных клеток, обнаружено наличие фукозы [20]. Не исключается, что этот минорный моносахарид постоянно присутствует во всех препаратах ГУК, но, возможно,что он встречается в отдельных ее представителях, обладающих особыми функциями. Изолированные из различных объектов препараты ГУК всегда содержат некоторые количества не отделяющегося при всех методах очистки белка, содержащего треонин, серии, аспарагиновую и глутаминовую кислоты, глицин, валин и другие аминокислоты, которые присутствуют в белковых компонентах протеогликанов [8, 9, 24, 68, 90, 96]. Таким образом, ГУК представляет собой протеогликан с низким и сильно варьирующим количеством ковалентно связанного белкового (полипептидного) компонента.
В физическом отношении ГУК характеризуется как биополимер, молекулярные параметры которого могут различаться в зависимости от вида организма, органа, ткани и т. п. Препараты ГУК, выделенные из одного исходного материала, неоднородны по молекулярной массе, которая обычно находится в пределах 2—3,1 • 105— 2—3.1 • 106 и может достигать порядка 107 дальтон, длина ее цепи составляет 0,5—5,0 мкм [28, 44, 46, 47, 96]. Длина и гибкость макромолекулы ГУК в значительной мере изменчивы. Доминирующее влияние на конформацию макромолекулы ГУК, как и других протеогликанов, оказывает природа катиона. Особенно активны в этом отношении Са2+ и Mg2+ [5—7]. В твердом состоянии ГУК обнаруживает значительную вариабельность конформации и упаковывается так, что соседние цепи становятся антипараллельными. На упаковку влияют также природа катиона, степень гидратации и наличие в препаратах других протеогликанов [29]. Показано, что Na-соль ГУК, не содержащая воды, имеет элементарную ячейку тетрагональной формы (а=b =0,989 нм. с = 3,381 нм). Цепь ГУК представляет собой спираль, закрученную в левостороннем направлении, из 4-кратных дисахаридных единиц. В такой структуре имеются интрамолекулярные водородные связи ОН....О через 1>3 гликозидные связи и NH....O через 1> 4гликозидные связи, а также координационные связи О....Nа....О. При относительно высокой увлажненности Nа+-гиалуроната возникает орторомбическая форма элементарных ячеек (а = 1,153 нм, b = 0.989 нм и с = 3,380 нм). Орторомбическая форма содержит по крайней мере 4 молекулы воды на тетрасахаридную единицу полимера. Обе формы сходны по водородным связям и ионным «мостикам.» [28, 29, 43]. С помощью ядерного магнитного резонанса установлено, что ГУК обладает стерическим расположением донорных и акцепторных групп, которое необходимо для возникновения стабильных водородных связей между ацетамидными, карбоксилатными группами , как показано на рис. 1 [23, 93, 94].
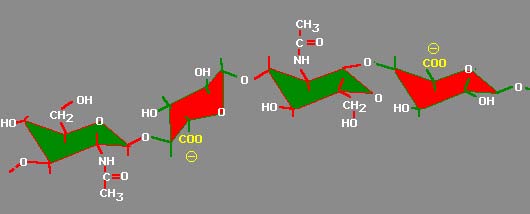 Рис.1 Структура тетрасахаридного сегмента ГУК [94].
Рис.1 Структура тетрасахаридного сегмента ГУК [94].
Расположение водородных связей в ГУК зависит от природы катиона, что выявлено методом ИК-спектроскопии. Более того, в агрегатах протеогликанов (см. ниже) расположение водородных связей так же зависит от природы катиона [5, 6]. Методами ядерного магнитного резонанса и окисления ГУК периодатом показано, что конформационные особенности макромолекулы ГУК, обусловленные водородными связями, карбоксилатными, ацетамидными и гид-роксильными группами, сохранятся и в водных растворах ГУК [93, 95].
Факторы, определяющие вторичную структуру макромолекулы ГУК в твердом состоянии, могут влиять на нее и в водных растворах, что следует из результатов вискозиметрических и других исследований. В то же время в водных растворах макромолекулы ГУК могут существовать и в виде неупорядоченных клубков, захватывающих пространство, в 103—104 раз большее, чем собственный объем цепей макромолекул. Наличие водородных связей способствует развертыванию клубков при физиологических значениях ионной силы и pН [78]. Об особенностях и исключительной лабильности конформации макромолекул ГУК свидетельствует то, что при pН 12,5 водного раствора Nа+-гиалуроната происходит резкое, но обратимое при pН 7,0 снижение вязкости без изменения молекулярной массы, что является специфичным для ГУК [67]. Методами ядерного магнитного резонанса и кругового дихроизма определены наличие чередующихся между собой относительно более жестких и более гибких структур в цепи ГУК и существование равновесия между этими структурами. Исключительно высокая вязкость и другие уникальные свойства растворов ГУК, помимо обусловленных выше отмеченными особенностями ее макромолекул являются также следствием специфических и неспецифических межмолекулярных взаимодействий макромолекул ГУК [30]. Контактные взаимодействия между макромолекулами ГУК приводят к образованию межмолекулярных ассоциаций, имеющих ячеистую структуру и захватывающих еще большее пространство, чем ее неупорядоченные клубки. Динамические свойства таких сложных структур увеличиваются с повышением ионной силы и понижаются с уменьшением pН раствора. Изолированный в близких к физиологическим условиях ионной силы и pН Nа+-гиалуронат, состоящий из 35000 дисахаридных единиц, в растворах в результате взаимодействия цепей быстро образует пространственные структуры, что обнаруживается вискозиметрическими и другими методами. Добавление к таким растворам, в равной концентрации фрагментов макромолекулы ГУК, состоящих из 60 дисахаридных единиц, разрушает структурные ассоциации и в реологическом отношении. Смешанные растворы ведут себя как растворы изолированных неассоциированных цепей ГУК. Очень короткие (из 4 дисахаридных единиц) и очень длинные (из 400 дисахаридных единиц) фрагменты не обладают указанным действием [115]. Конформационные особенности ГУК определяют вязкоэластические свойства ряда биологических жидкостей, межклеточного матрикса и прочих структур, образующихся с участием ГУК и других протеогликанов. Уменьшение полимерности нескольких макромолекул ГУК при патологических состояниях может повлечь диспропорциональные нарушения нормальных структур, образованных высокополимерной ГУК, что опасно для систем, выполняющих оптические и механические функции (стекловидное тело глаза, пуповина, синовиальная жидкость и др.), в которых ГУК является преобладающим протеогликаном. Образуя в растворах ячеистые структуры, цепи макромолекул ГУК придают растворам способность противостоять деформирующему действию давления извне. Создание «буферного объема» из ГУК между фибриллами и волокнами в определенных образованиях может быть основано на этих ее свойствах [95].
ГУК, связывая значительные количества воды и образуя ячеистые структуры в растворе, контролирует распределение других одноименно заряженных макромолекул посредством стерического исключения из заполненного макромолекулами ГУК объема. Линейные макромолекулы, несущие электрический заряд, образующие в растворе трехмерные структуры, оказывают большее исключающее стерическое действие, чем компактные макромолекулы [62]. Такой эффект приводит к концентрированию вытесненных из основного пространства макромолекул в предельно ограниченном при данных условиях объеме, что может способствовать различным взаимодействиям их между собой и приводить к образованию новых структур. ГУК может электровалентно взаимодействовать с низко- и высокомолекулярными положительно заряженными веществами. Наиболее выраженно это проявляется в слабокислой среде, где соединение ГУК с указанными веществами выделяется в виде нерастворимых комплексов [2, 61]. В физиологических пределах ионной силы и pН электровалентное взаимодействие ГУК с белками и другими веществами, не приводящее к выделению нерастворимых комплексов, может иметь своим последствием определенную пространственную ориентацию макромолекул, что выразится в возникновении гетерогенных по макромолекулярному составу структур.
Исследования взаимодействия ГУК с другими протеогликанами проводились главным образом в связи с изучением матрикса различных видов соединительной ткани [45, 46, 51, 100]. Почти все наиболее важные результаты по данному вопросу были получены в исследованиях матрикса хряща, сведения о протеогликанах которого представлены в таблице.
Состав протеогликанов хряща
|
Компонент |
Моносахаридные
компоненты
гликозамино-
гликанов |
Число цепей,
групп на
макромолекулу протеогликана
|
Молекулярная
масса
компонента
дальтон |
Содержание в макромолекуле.
Средний % от
молекулярной
массы
|
|
Белок (стержень) |
- |
17 |
2•103—3•106 |
7-12 |
|
Хондроитин- сульфаты (4 и 6) |
D•N ацетилгалактозамин
и D-глюкуроновая кислота |
100 |
3•104—3•106 |
80-85 |
|
Кератинсульфат |
D•N-ацетилглюкозамин
и D-галактоза |
30 |
4•103-8•105 |
5-10 |
|
Олигосахариды |
- |
50 |
12•103-2•105 |
1-3 |
|
О-сульфатные группы |
- |
4500 |
- |
- |
|
Карбоксильные группы |
- |
4200 |
- |
- |
|
Всего заряженных групп |
- |
8700 |
- |
- |
Матрикс хряща (около 90% объема этой ткани) состоит (в расчете на сухую массу) из 40—70% коллагена типа II и 10—30% сульфатсодержащих протеогликанов (С-протеогликаны). Последние представляют собой комплексы с молекулярной массой 0,5·10б—4,0-·106 дальтон, состоящие из белкового стержня, к удлиненной части (до 350 нм) которого ковалентно присоединено около 100 цепей хондроитинсульфатов и 30—60 цепей кератансульфатов [4, 6, 8].
Около 90% хондроитинсульфатов расположено на белковом стержне в отдалении от так называемого ГУК-связывающего участка данного белка, а 60 % кератансульфата сосредоточено в области, примыкающей к этому участку. Интересно, что этот белковый стержень синтезируется до образования указанного комплекса [75]. Кроме того, к белковому стержню присоединено N-гликозидной связью значительное количество олигосахаридов (см. таблицу; рис. 2). Существует семейство протеогликанов хряща, представляющпх собой протеинхондронтинкера-тансульфаты (ПХКС), различающиеся по молекулярной массе, величина которой
зависит от длины белкового стержня, числа присоединенных глико-заминоглнканов, соотношения изомеров хондроитинсульфатов и олигосахаридов [26, 27, 51, 52, 63]. Хондроитин и кератансульфаты определяют глав-ные свойства протеоглнканов матрикса хряща, а белковый стержень формирует распределение и плотность упаковки вдоль него гликозаминогликанов, на конформацию которых могут влиять олигосахариды, ковалентно связанные с этим стержнем. Одна молекула гликозаминогликана, соединяясь с белковым стержнем, взаимодействует с 4— 6 аминокислотными остатками. Наиболее крупные макромолекулы протеогликанов содержат относительно больше гликозаминогликанов и меньше белка. Часть белкового компонента протеогликанов хряща, так называемый ГУК-связывающий участок эллипсоидной формы (15х3х3 нм, мол. масса 5.5·104 Д), содержащий олигосахариды, ковалентно соединен с длинной частью этого компонента перпендикулярно к его длинной оси [34, 45. 46, 63]. Протеогликаны, содержащие хондроитинсульфаты,
продуцируемые различными типами клеток, могут различаться по размерам гликозаминогликановых цепей и белкового стержня [120]. Высокая молекулярная масса, развернутая структура, гибкость гликозаминогликановых компонентов и белкового стержня, исключительная гидрофильность протеогликанов обеспечивают им возможность создавать в растворах трехмерные структуры, обладающие рядом свойств, которые присущи структурам ГУК [10, 11, 33, 105].
 Рис. 3. Схема структуры агрегатов протеогликанов хряща позвоночных животных [44].
Рис. 3. Схема структуры агрегатов протеогликанов хряща позвоночных животных [44].
а —протеогликан; 6 — связующий белок; в — гиалуронат; г — агрегат протеогликанов.
В матриксе хряща значительная часть протеогликанов находится в виде агрегатов, возникающих посредством соединения эллипсоидной части белкового компонента протеогликана с ГУК при участии связующего (стабилизирующего) белка (рис. 3). К од-нон макромолекуле ГУК с мол. массой 2·105—2·106 Д и длиной 0,5—5,0 мкм может присоединиться от 20 до 250 молекул С-протеогликанов (мономеров) па расстоянии между ними 25— 50 нм, в результате чего образуются агрегаты протеогликанов (АПГ). Одна цепь ГУК с мол. массой 1.6-106 Д может присоединить 200 протеогликанов. в результате чего получается агрегат с мол. массой 3.5·108 Д и длиной 4 мкм [33, 46]. Мономеры-протеогликаны в агрегатах расположены радиально вдоль цепи ГУК, и длина этих протеогликанов, определяемая длиной их белкового стержня, остается неизменной (580 нм) после соединения с ГУК. АПГ имеют форму эллипсоида, длина главной оси определяется степенью растяжимости цепи ГУК [55].
Обнаружены два вида связующего белка, различающиеся по молекулярной массе. В более легком из них отсутствуют углеводные компоненты [21, 44, 51, 59, 103]. Связующий белок может секретироваться клетками в больших количествах, чем необходимо для стабилизации АПГ. Очевидно, что одним из важнейших факторов, управляющих образованием стабильных АПГ в хряще, является наличная концентрация ГУК [45, 46].
АПГ не диссоциируют в физиологических пределах pН и ионной силы. Полная и обратимая диссоциации АПГ на мономеры-протеогликаны, ГУК и связующий белок происходят при высоких концентрациях (2—4 М) гуанидина гидрохлорида, MgCl2, СаСl2 и CsCl, а в 4 М мочевине они не диссоциируют. Молекулярные массы мономеров-протеогликанов, отделенных от связующего белка и ГУК, находятся в пределах величин молекулярных масс неагрегирующихся протеогликанов хряща. Изменением pН и ионной силы раствора можно вызвать диссоциацию АПГ на протеогликаны, связующий белок и ГУК или на ГУК и протеогликаны, соединенные с этим белком. Продукты диссоциации вновь соединяются в АПГ при значениях pН и ионной силе, способствующих ассоциации. Включение связующего белка в комплекс ГУК-протеогликаны необходимо для стабилизации АПГ [42, 52, 60]. Взаимодействие эллипсоидной части белкового компонента протеогликанов с ГУК является строго специфичным. ДНК, хондроитинсульфаты, дерматан-сульфат, гепарин [3], несульфатированный промежуточный продукт биосинтеза гепарина и хондроитин, отличающийся от ГУК соответственно гликозидными связями и положением гидроксильной группы при С4 аминосахара, и декстрансульфат не образуют агрегаты с протеогликанами [48, 49]. Для соединения эллипсоидной части белкового компонента протеогликана с ГУК необходимо наличие в этой части остатков аргинина и лизина и 4 карбоксильных групп на каждый декасахаридный фрагмент ГУК. В растворах при pН 3,0—4,0 происходит обратимая диссоциация АПГ. Однако, кроме электровалентного взаимодействия, для устойчивого соединения протеогликанов с ГУК необходимо наличие в эллипсоидной части неблокированного остатка триптофана и немодифицированной третичной структуры. По-видимому, весь объем гликозаминогликанов, соединенных с белковым стержнем, а не только эллипсоидная часть белкового компонента, определяют упаковку протеогликанов вдоль макромолекулы ГУК [48—50, 52]. ПХКС в 0,15 М растворе NaCl при pН 7,0 в присутствии ГУК может образовать с ней агрегаты в отсутствие связующего белка. Такие нестабилизированные указанным белком АПГ диссоциируют в кислой среде при высоких концентрациях гуанидин гидрохлорида, MgCl2 и в 6 М мочевине при 60°, но не диссоциируют в концентрированных растворах NaCl и CsCI [42, 52].
Стабильные АПГ обнаружены в культурах хондросаркомы (Swarm), ЗТЗ клеток мышей, глиальных клетках [44, 51, 87]. У крупного рогатого скота одних и тех же возраста и пола в про-теогликанах суставного хряща содержится меньше, хондроитинсульфатов и больше кератансульфата, чем в таковом носовой перегородки и трахеи, но все они в одинаковой степени способны образовывать агрегаты с ГУК. В суставном хряще по мере удаления от поверхности и вглубь ткани, протеогликаны содержат больше кератансульфата и меньше хондроитинсульфатов, в то время как количество АПГ не зависит от глубины и составляет около 90 % всех протеогликанов ткани [37, 38]. В эластиновом хряще и
некоторых других видах соединительной ткани содержание ГУК превышает таковое, необходимое для включения всех имеющихся в них С-протеогликанов в АПГ [119]. Выделенные из культуры глиальных клеток мозга человека протеогликаиы (ПХКС) образуют в растворе в присутствии ГУК агрегаты, что подавляется прибавлением к смеси дека- и тетрадисахаридных фрагментов ГУК [87].
ГУК является единственным из всех протеогликанов, способным ориентировать и концентрировать вокруг себя макромолекулы ряда других протеогликанов, создавая сложные гетерогенные стерические структуры, что в предельной форме выражается в образовании АПГ различной степени устойчивости, в зависимости от участия связующего белка. Образование стабильных АПГ является механизмом иммобилизации макромолекул протеогликанов внутри коллагеновых и эластиновых каркасов соединительной ткани. АПГ несут высокий концентрированный отрицательный заряд, обладают исключительной гидрофильностью и значительно большей эластичностью, чем неагрегированные протеогликаны, что особенно важно для систем, несущих переменные механические нагрузки [66, 82]. Изолированные АПГ обладают более сильно выраженной, чем ГУК, способностью создавать в растворах трехмерные структуры, обладающие свойством стерического исключения других элементов из пространства, заполненного такими структурами [13].
Во многих тканях, клетках и клеточных органеллах при наличии в них ГУК, протеогликанов, состоящих из изомеров хондроитннсульфата и кератансульфата, и других протеогликанов стабильные АПГ не образуются. Heaгрегированные С-протеогликаны наряду с АПГ содержатся во всех видах хряща. Поскольку С-протеогликаны в тканях и клетках всегда присутствуют совместно с ГУК в тех или иных количественных соотношениях, то между ГУК и другими протеогликанами могут возникнуть и в отсутствие связующего белка сложные подвижные структуры, что наблюдается в модельных опытах [11]. Такие структуры в тканях в зависимости от физиологических ситуаций могут быстро и легко возникать и распадаться. Постоянно присутствующие в хряще и не вступающие в агрегаты с ГУК протеогликаны, вероятно, необходимы для подобного структурирования, когда это требуется по физиологическим условиям.
Представляют интерес исследования в целях выявления взаимодействия ГУК с другими протеогликанами, гликопротеидами и липопротеидами. Из хондроцитов суставного хряща человека, клеток хондросаркомы крыс (Swarm) и аорты крупного рогатого скота выделены комплексы ГУК с дерматансульфатом [80]. В аорте крупного рогатого скота обнаружены два комплекса, различающиеся по молекулярной массе, содержанию изомеров хондроитинсульфатов и ГУК [69]. Из фиброзных бляшек (fibrous plague lesions) аорты человека выделены ассоциаты ГУК с липопротеидами сыворотки крови. По-видимому, ГУК принадлежит определенная роль захватывания и связывания липопротеидов в матриксе соединительной ткани аорты [99]. Эти данные представляют интерес в связи с участием гепарина в освобождении липопротеидлипазы из ее комплекса с гепарансульфатом, находящегося на поверхности эндотелиальных клеток [3]. Большое значение имеют исследования взаимодействия ГУК с фибронектином клеток, так как этот фосфогликопротеид участвует в осуществлении контакта клетки с клеткой. Фибронектин клеток обладает сродством к ГУК только в форме мультимера, в которой он отличается в конформационном отношении от димера - его обычной формы. В мультимерной форме фибронектина создаются структуры, реагирующие с ГУК и ее фрагментами, состоящими из 50 дисахаридных единиц. Очевидно, для соединения ГУК с фибронектином клеток не требуется стабилизации ее макромолекулярной структуры [4].
Биосинтез ГУК в организме млекопитающих мало изучен. Предполагается, что он осуществляется последовательным присоединением N-ацетилглюкозамина и глюкуроновой кислоты, в результаты чего создается длинная неразветвленная цепь макромолекулы ГУК. О сложности механизма биосинтеза ГУК свидетельствует то обстоятельство, что в коже мышей эстрогены сильно и одновременно увеличивают синтез ГУК и число специфических рецепторов эстрогена в данном органе.
Поскольку антиэстрогены подавляют синтез ГУК, предполагается, что увеличение ее синтеза в указанной ситуации вызывается| индуцированием ферментной системы, осуществляющей синтез ГУК [ l l l ]. Для изучения механизма биосинтеза ГУК широко используется гемолитический стрептококк группы А, не синтезирующий никакие другие протеогликаны, кроме ГУК. Из свободных от клеток этого микроорганизма энзиматических систем, синтезирующих ГУК, получены две фракции вновь синтезированной ГУК одинаковой молекулярной массы, одна из которых находится в процессе удлинения цепи молекулы ГУК. Инкубирование энзиматической системы с УДФ·[14С]-глюкуроновой кислоты приводит к включению [14С]-глюкуроновой кислоты в эту фракцию. Предполагается, что синтез ГУК в организме гемолитического стрептококка осуществляется удлинением, ее цепи путем постепенного присоединения глюкуроновой кислоты и N-ацетилглюкозамина синтезирующей системой, связанной с мембранами, и последующей реализации с них готовой макромолекулы ГУК [101].
ГУК может регулировать биосинтез других протеогликанов. Добавленная к культурам зрелых хондроцитов ГУК вызывает быстрое перемещение синтезируемых ими С-протеогликанов из клеточного слоя в культуральную среду, где они образуют агрегаты с добавленной ГУК. Более высокие концентрации ГУК подавляют включение [35S]-сульфата в протеогликаны, что сопровождается увеличением количества ГУК, связанной с поверхностью клеток [91; 97, 98, 116]. Предполагается, что понижение синтеза С-протеогликанов в таких опытах вызывается подавлением синтеза белкового стержня или активности ?-ксилозилтранс-феразы, необходимых для синтеза С-протеогликанов [51]. Однако указанное действие ГУК не является универсальным. В культурах, фибробластов большие количества экзогенной ГУК не вызывают депрессии синтеза С-протеогликанов [117, 118]. По-видимому, пути биосинтеза ГУК отличаются от таковых синтеза С-протеогликанов. Монезин, подавляя включение [35S]-сульфата и [3Н]-галактозамина в С-протеогликаны в клетках культуры саркомы крыс, не влияет на включение [3Н]-глюкозамина в ГУК, так же синтезируемую этими клетками [76] .
ГУК вместе с другими протеогликанами участвует в миграции клеток, дифференциации тканей и морфогенезе. При эмбриогенезе отмечается зависимость между накоплением ГУК и увеличением миграции клеток, а также между наступающей затем деградацией ГУК в период прекращения миграции клеток и началом их дифференциации [44, 51, 98,104]. Показано, что экстрацеллюлярная концентрация ГУК является одним из регулирующих факторов дифференциации зародышевой хрящевой ткани в зрелый хрящ [58, 64]. Изучение миогенеза в культурах выявило, что миотубы содержат значительно больше ГУК, чем С-протеогликанов, и, что ГУК, находящаяся на поверхности клеток, более высокополимерна, чем ГУК культуральной среды. Формированию миотубов предшествует создание высокого отношения содержания ГУК к содержанию С-протеогликанов на поверхности клеток и в культуральной среде. По-видимому, на размещение миобластов и фибробластов, имевшее место до начала формирования миотубов, влияет сдвиг отношения ГУК/С-протеогликаны. Миотубы в культурах синтезируют ГУК в количествах, в 8 раз превышающих синтез других протеогликанов. В организме они также окружены большим количеством ГУК. Вообще, все растущие и дифференцирующиеся ткани характеризуются высокой величиной отношения ГУК-С- протеогликаны [18, 19]. Важные результаты получены при совместном культивировании эмбриональных печеночных клеток (эпителиальных) и фибробластов курицы. В отдельных культурах первые клетки продуцируют мало С-протеогликанов или совсем их не образуют. В совместных же культурах указанных клеток при преобладающем количестве первых из них имеют место значительное увеличение, синтеза ГУК и уменьшение образования С-протеогликанов. При этом отношение ГУК/С-протеоглнканы прогрессивно растет. Фибробласты, культивируемые в среде роста клеток печени, .увеличивают синтез ГУК и С-протеогликанов так, что отношение ГУК/С-протеогликаны не изменяется. Клетки же печени в среде роста фибробластов не обнаруживают изменений в уровне С-протеогликанов. Из этого следует, что только фибробласты ответственны за увеличение уровня ГУК, а снижение уровня С-протеогликанов является результатом тесной близости двух типов клеток в совместных культурах. Эти данные подтверждают концепцию, согласно которой некоторые виды эпителиальных тканей способны влиять на количественные соотношения между отдельными протеогликанами в матриксе примыкающей к ним соединительной ткани [70]. Таким образом, ГУК выполняет важную роль одного из посредников во взаимодействии клеток между собой и между тканями.
Многие (если не все) клетки способны связывать ГУК. На поверхности SV-3T3 клеток, трансформированных лимфоцитов, макрофагов и некоторых иных клеток мышей и других животных, имеются рецепторы, соединяющиеся с ГУК [41, 53, 74]. Количество связанной с клетками эндогенной ГУК зависит от вида клеток, их физиологического состояния и степени трансформации. В культурах хондроцитов курицы, трансформированных вирусом Рауса, наблюдается значительное уменьшение количества ассоциированной с клетками ГУК и увеличение связанных с ними хондроитинсульфа-тов [41, 54, 74, 79, 102]. Обработка клеток трипсином исключает их способность связывать ГУК [19]. С увеличением молекулярной массы ГУК возрастает ее сродство с поверхностью клеток, поскольку каждая макромолекула ГУК соединяется с большим числом рецепторов (доменов). Когда одна макромолекула ГУК соединяется рецепторами разных клеток, образуются агрегаты клеток. Связывание ГУК клетками увеличивается с понижением температуры до 18°С, что соответствует температуре фазового перехода мембран. Разумеется, что связывание не текучей мембраной больше, чем текучей [109,110]. Прибавленная к культурам фибробластов мыши [14С] -ГУК быстро связывается с поверхностью клеток и для отделения ее требуется обработка клеток трипсином. Кроме того, это прибавление сопровождается выделением С-протеогликанов в среду, изменением поверхности клеток и их. миграцией. В культурах SV-3T3 клеток связывание [14С]-ГУК происходит более эффективно, но оно подавляется высокими концентрациями фрагментов ГУК, состоящими из 6 и более моносахаридных остатков. SV-3T3 клетка может связать 3·103 молекул ГУК с молекулярной массой 2·106 Д [19]. Предполагается, что места на мембранах, связывающие ГУК, неспецифичны для N-ацетилглюкозамина, но специфичны для глюкуроновой кислоты, поскольку дерматансульфат, содержащий 80 % идуроновой кислоты и 20 % глюкуроновой кислоты, менее активен в отношении связывания с клетками, чем хондроитинсульфаты. Соединение ГУК с клетками не зависят от Са2+ и Mg2+. He исключается, что связь ГУК с поверхностью клеток может быть ковалентной [54, 74].
Еще в более ранних работах показано, что прибавление к культурам различных клеток небольших количеств ГУК вызывает их агрегацию, а большие количества подавляют ее [35,83, 108, 112]. В клетках с высоким уровнем собственной ГУК агрегация их более легко подавляется экзогенной ГУК. С-протеогликаны менее активны в указанном отношении. Подавление агрегации, клеток высокими концентрациями ГУК не связано с повышением вязкости среды за счет этой кислоты, так как растворы декстрансульфата такой же вязкости не подавляют агрегацию клеток в тех же культурах [19]. Выяснено, что существуют независимый от Са2+ и Mg2+ и зависимый от этих катионов механизмы агрегации клеток SV-3T3, SV-PY-3T3 и других линий. Не зависимая от Са2+ и Mg2+ агрегация осуществляется соединением одной макромолекулы ГУК с несколькими клетками, и обработка клеток специфической гиалуронидазой полностью подавляет их агрегацию в отсутствие Са2+ и Mg2+и только частично подавляет ее в присутствии этих катионов, Вероятно, зависимая от Са2+ и Mg2+ агрегация не нуждается в ГУК, что подтверждается полным подавлением агрегации избытком ГУК в отсутствие данных катионов и ослаблением подавляющего действия агрегации избытком ГУК в присутствии их [108]. Изучение агрегации зерен ионообменной смолы (Dowex Ag 50-N-х—l, меш 50—100), соединенных с ГУК и различными гликозаминогликанами, содержащими менее 0,10 % белка, выявило, что в смеси ГУК-зерен с хондроитинсульфат-4 и -6 зернами происходит их агрегация, которая не зависит от Са2+ и подавляется избытком свободных ГУК и хондроитинсульфатов. Предполагается, что взаимодействие происходит между гликозамино-гликановыми компонентами. В смеси ГУК-зерен с дерматансульфат- и гепарин-зернами, а также в гомологичных зернах агрегация не имеет место [106]. Интересно, что даже в значительно упрощенных модельных системах агрегация, вызываемая ГУК и хондроитинсульфатами, может не зависеть от Са2+ и подавляться избытком свободных тех же биополимеров.
Для рассмотрения вопроса о механизме участия ГУК и других протеогликанов в агрегации и адгезии клеток необходимо уточнить различия между этими процессами. Агрегация, в большинстве случаев предшествующая адгезии, представляет собой неспецифическое концентрирование клеток в ограниченном объеме в результате стерического исключения их из пространства, заполненного трехмерными структурами ГУК, других протеогликанов и АПГ, которые препятствуют их дальнейшей дисперсии и сближают поверхности клеток, не соединяясь с ними, на расстояния, необходимые для действия специфических и неспецифических механизмов следующей стадии соединения клеток между собой — адгезии. Разумеется, что в ряде случаев трудно четко определить границы между агрегацией и адгезией, так как механизмы этих явлений могут перекрываться. ГУК и некоторые С-протеогликаны в определенных условиях непосредственно или при участии других биополимеров (например, фнбронектина) могут быть специфическими и неспецифическими факторами адгезии, сохраняя при этом функции стерического исключения [11—13]. Возможно, что, кроме ГУК и других протеогликанов, способностью создавать самостоятельно или совместно с С:протеогликанами трехмерные структуры, стерически исключающие из заполненного ими пространства клетки, обладают также гликопротеиды с высокой гидрофильностью [36].
Высокая вязкость растворов ГУК, АПГ и остальных протеогликанов сама по себе не может быть фактором агрегации. При высоких концентрациях этих биополимеров (особенно при их совместном присутствии) образуемые ими трехмерные структуры ограничивают подвижность клеток. ГУК. ассоциированная с поверхностью клеток непосредственно или при участии фибронектина и других каких-либо протеидов, может по указанным причинам препятствовать агрегации клеток в зависимости от количественных соотношений между соединенной с клетками и находящейся в среде ГУК. Этим объясняется, почему в культурах, когда клетки синтезируют большие количества ГУК и значительная часть ее ассоциирована с их поверхностью, добавленная экзогенная ГУК к культурам действует как фактор, препятствующий агрегации. Соотношение ассоциированной с поверхностью клеток и включенной в трехмерные структуры матрикса ГУК имеет регулирующие значения в миграции, агрегации и дезагрегации клеток в процессах эмбриогенеза, как это видно из предыдущего материала статьи.
Наиболее демонстративно выявляется различие между неспецифической обратимой агрегацией и адгезией при изучении агрегации эритроцитов. Эритроциты кролика, суспензированные в 0,15 М NaCl (pH 7,4) в присутствии ГУК (>0,6 мг/мл), С-протеогликанов (>5,0 мг/мл) и АПГ (>0,2 мг/мл), быстро и обратимо разделяются на фазы раствора и агрегированных эритроцитов, что вызывается стерическим исключением их из пространства, заполненного в растворе трехмерными структурами указанных биополимеров [10—13]. Клетки сетчатки эмбриона курицы агрегируются С-протеоглика-нами при их физиологических концентрациях также посредством стерического исключения из жидкой среды. При этом клетки плотно соединяются между собой без образования «мостиков» протеогликанов. При наличии в среде специфических факторов адгезии имеет место синергизм в действии этих факторов и механизма стерического исключения. Клетки сетчатки эмбриона курицы, обработанные конканавалином А, агрегируются в присутствии С-протеогликанов значительно быстрее [77].
В адгезию клеток вовлекается множество специфических и неспецифических белковых веществ, глико- и липопротеидов, протеогликанов, а также других высоко- и низкомолекулярных веществ, принимающих прямое и косвенное участие в этом явлении [25, 40, 121]. В физико-химическом отношении в той или иной мере могут участвовать ковалентные, электровалентные и водородные связи, силы Ван-дер-Ваальса, диполъная ориентация, гидрофобные н комплементарные контакты и многие другие факторы [16, 17, 31, 32, 39, 84, 86, 113]. В задачу данной работы не входит подробное описание роли всех перечисленных выше факторов в специфической и неспецифической адгезии клеток. Ниже приведены сведения о некоторых механизмах клеточной адгезии только в той, мере, в какой это необходимо для понимания роли ГУК в неспецифнче-ской обратимой агрегации клеток, что мало освещено в литературе, несмотря на актуальность этого вопроса.
Существует ряд предположений об участии определенных энзиматических систем в адгезии клеток животного организма. Предполагается, что локализованные на поверхности многих клеток гликозилтрансферазы вступают в комплекс с находящимися на поверхности другой гомологичной клетки субстратом, т. е. незавершенным концом углеводного компонента гликопротеида, гликозаминогликана, гликопептида, а один из этих субстратов первой клетки образует комплекс с гликозилтрансферазой второй клетки, что связывает клетки по типу комплекса фермент — субстрат. В зависимости от концентрации в системе соответствующего УДФ-моносахарида может происходить частичное или полное глико-зилирование молекул субстрата, приводящее к ослаблению адгезии или диссоциации клеток [86, 88]. Кроме того, можно предположить, что адгезия асцитных и других клеток увеличивается после прибавления к культурам L-глютамина, необходимого для синтеза гексозаминов, которые при участии УДФ и гликозилтрансфераз включаются в полисахаридные цепи гликозаминогликанов и гликопротеидов, участвующих в адгезии клеток. Специфическое активирование и угнетение глутаминсинтетазы в клетках могут управлять их адгезией, поскольку от количества глутамина зависит синтез указанных выше биополимеров [81]. Значительная роль энзиматическим системам отводится и в гипотезе, по которой адгезия и миграция клеток, особенно в эмбриогенезе, могут регулироваться в определенной степени сокращением и расслаблением находящегося на поверхности ряда клеток актомиозинподобного белка при участии АТФ. Определяющие активность этого белка система АТФ— АДФ, Са2+ и Mg2+ могут изменять распределение зарядов на поверхности клеток, форму самих клеток и этим влиять на поведение их в указанных отношениях [56, 57]. В культурах различных клеток человека, а также мышей и некоторых других животных на поверхности клеток имеется энзиматическая система, фосфорилирующая белки (фибронектин и другие) посредством АТФ и ГТФ, но без участия циклических АМФ, ГМФ и ЦМФ. Допускается, что она имеет значение для адгезии клеток [85]. Высказано мнение, что адгезия клеток может происходить по типу реакции антиген —антитело, когда на поверхности клеток находятся вещества, подобные веществам групп крови, и при наличии в среде антител к ним. Вероятно, такие взаимодействия имеют место в узнавании клеток и специфической адгезии их при эмбриогенезе [89]. Из множества гипотез о механизме специфической и неспецифической адгезии клеток позвоночных животных невозможно выбрать одну, наиболее полно объясняющую механизм этого сложного биологического явления. Почти все объяснения механизма адгезии клеток обоснованы фактическими данными, полученными на культурах клеток и тканей, отличающихся отсутствием регуляторных систем, функционирующих в организме, относительной однородностью окружающей клетки среды, наличием особых адаптации к условиям этой среды и многими другими моментами [4]. Все это вносит трудности и ограничения в использование результатов таких исследований для объяснения взаимоотношения различных механизмов специфической и неспецифической адгезии клеток в организме, но в механизмах, выявленных в культурах, едва, ли можно сомневаться.
В условиях организма в зависимости от вида клеток, их состояния, внутренней среды и многих других моментов одни и те же факторы специфической и неспецифической адгезии клеток, вероятно, могут быть попеременно определяющими и второстепенными. Однако одна из множества функций ГУК и других протеогликанов — функция неспецифической обратимой агрегации различных клеток посредством стерического вытеснения — остается постоянной. При любых механизмах адгезии клеток и особенно если она осуществляется с участием гликозилтрансфераз, глютаминсинтетазы и других ферментных систем, когда устойчивость адгезии может волнообразно изменяться, роль ГУК и других протеогликанов как стабилизирующего барьера является физиологически необходимой. При этом синтез ГУК и ее распад также зависят от активности соответствующих энзиматических систем. Кроме того, в зависимости от соотношения между количеством ГУК, ассоциированной с клеточной поверхностью, и количеством ее в межклеточном пространстве трехмерные структуры ГУК могут посредством стерического исключения направлять другие макромолекулы к клеткам или от них и таким путем влиять на концентрацию в окружении клеток молекул, требующихся для их существования, дифференциации, контакта и взаимодействия друг с другом [77]. Параллельно с этим ГУК осуществляет и транспорт воды, ионов и низкомолекулярных веществ.
Стерическое исключение, производимое ГУК, С-протеогликанами и АПГ, имеет значение в зарождении и росте фибрилл коллагена, помимо других механизмов участия этих биополимером в фибриллогенезе коллагена [2, 14, 119]. Распространенный повсеместно в организме млекопитающих гепарин уменьшает и полностью разрушает агрегацию клеток, вызванную стерическим исключением ГУК и другими протеогликанами. Возможно, что гепарин препятствует образованию трехмерных структур ГУК и придает более высокий отрицательный заряд клеткам [3, 12].
Сформулированные здесь представления о неспецифической обратимой агрегации клеток, осуществляемой ГУК и другими протеогликанами, предшествующей адгезии, согласуются с данными других исследователей. Клетки печени и сетчатки эмбриона курицы сначала обратимо агрегируются без вовлечения специфических рецепторов адгезии и без затраты метаболической энергии. Затем наступает селективная адгезия клеток, требующая метаболической энергии, и клетки соединяются стабильной связью. Допускается, что обратимая агрегация может переходить в стабильное соединение клеток [107]. Пространственное исключение клеток и концентрирование их в ограниченном объеме, осуществляемое трехмерными структурами ГУК, непосредственно не связаны с метаболической энергией и в этом заключается глубокий биологический смысл таких структур. В условиях развивающегося животного организма в образовавшиеся агрегаты клеток сразу же врастают соединительнотканные элементы с высоким содержанием ГУК, указанные выше структуры которой препятствуют дезагрегации образовавшихся ассоциатов клеток [16]. Пожалуй, можно утверждать, что, если специфическая и неспецифическая адгезия клеток осуществляется множеством веществ и факторов, то неспецифическая и обратимая агрегация, предшествующая адгезии, осуществляется главным образом ГУК и рядом других протеогликанов.
Кроме изложенных выше функций, ГУК прямо или косвенно принимает участие в самых разнообразных биологических явлениях. В культурах различных видов сарком и карцином ГУК защищает опухолевые клетки от лизиса, опосредованного лимфоцитами [05]. ГУК подавляет, а в некоторых случаях стимулирует активность мо-но- и полинуклеарных фагоцитов. Она же подавляет миграцию и митоз лимфоцитов, миграцию клеток лимфомиелоидной системы, чувствительность клеток к некоторым вирусам, проникновение спорозоидов и взаимодействие между клетками мишени и лимфоцитами. Из этого следует, что ГУК непосредственно включается в процессы воспаления и иммунитета, но механизм ее участия в них не изучен. Благодаря вязкоэластическим свойствам растворов ГУК амортизируются удары в стекловидном теле глаза, что предотвращает отслоение сетчатки и пигментного эпителия [22]. В пуповине ГУК препятствует сдавливанию кровеносных сосудов и этим обеспечивает нормальное развитие плода. Поверхность хряща выстлана слоем комплекса ГУК-протеогликаны, защищающим эту поверхность во время функционирования сустава. Однако этим не ограничивается значений ГУК в функции суставов. С возрастом указанный слой становится тоньше [114]. ГУК, соединяясь с лекарственными веществами, способна в виде таких соединений транспортировать их к клеткам, а также выделять их в нерастворимой форме в матриксе соединительной ткани посредством стерического исключения [15].
По химической природе и структуре, относительно менее высокому электрическому заряду, низкому содержанию ковалентно связанного белкового (полипептидного) компонента ГУК является сравнительно более простым протеогликаном. Возможно, что именно этими особенностями ГУК обусловлены ее резко выраженные способности создавать в растворах пространственные структуры и уникальная роль как фактора, организующего сложные надмолекулярные образования с участием С-протеогликанов и гликопротеидов, а также многие другие биологические функции.
ЛИТЕРАТУРА
1. Бычков С. М. — Успехи совр. биол, 1948, т. 25 ,№ 1, с. 1.
2. Бычков С.М. —Докл. АН СССР, 1950, т. 75, № 1. с. 83.
3. Бычков С. М. — Вопр. мед. химии, 1981, № 6, с. 726.
4. Бычков С. М. —Там же, 1983,№ б, с. 2.
5. Бычков С. М. Богатов В. Н., Кузьмина С. А. — Бюл. экспер. биол.. 1981, № 9, с. 302.
6. Бычков С. М., Богатов В. Н., Кузьмина С. А.—Там же, 1982 № 11, с.52.
7. Бычков С. М., Богатов В. Н. Харламова В. Н. —Там же, 1980, № 6, с. 680.
8. Бычков С. М., Захарова М. М. — Вопр.мед. химии, 1979, № 3, с. 227.
9. Бычков С. М., Колесникова М. Ф. — Биохимия, 1969, № 1, с. 204.
10. Бычков С. М., Кузьмина С. А. — Бюл.экспер. биол., 1973, .№ б, с. 41.
11. Бычков С. М., Кузьмина С. А. — Там же,1977, ,№3, с. 284.
12. Бычков С. М., Кузьмина С. А. — Там же.№ 11, с. 562.
13. Бычков С. М. Кузьмина С. А.—Там же,1983, № б, с. 58.
14. Бычков С. М., Фомина В. А. — Вопр. мед.химии, 1958, № 1, с. 59. _
15. Бычков С. М., Харламова В. Н.—Там же,1972, № 3, с. 269.
16. Поликар А. Поверхность клетки и ее микросреда. Пер. с франц. М 1975.
17. Тринкаус Дж. От клеток к органам. Пер.с англ. М., 1972.
I8. Angello J. С., Hauschka S. D. — Develop.Biol, 1979, vol. 73, p. 322.
19. Angello J. C., Hauschka S. D. — Exp. Cell Res., 1980, vol. 125, p. 389.
20. Axelsson I., Heinegard D. — Upsala J. med. Sci., 1977, vol. 82, p. 120.
21. Baker J. R., Caterson B. C. — J. biol.Chem., 1979, vol. 254, p. 2387.
22. Balazs E. A. — Upsala J. med. Sci., 1977.vol. 82, p. 94.
23. Bochk S. M., Dorke A. H., Velth D .Rees D. A. — Europ. J. Biochem., 1980.vol. 109, p. 447.
24. Chakrabarti В., Hultsch E. — Biochem. bio-phys. Res. Commun., 1976, vol. 71, p. 1189.
25. Cederberg B. M.t Gray G. R. — Analyt.Biochem., 1979, vol. 99, p. 221.
26. Christner J. E., Brown M. L., Dziewiatkowski Djfe — Biochem. J., 1977, vol. 167.p.741
27. Chrisijtj J. E., Brown M. Lt Dzieviarkowskfi K. D. — Analyt. Biochem., 1978.vol. 90. p. 23.
28. Cleland R L — Upsala J. med. Sci.. 1977.vol. 82, p. 86.
29. Cleland R. L — Arch. Biochem. 1977.vol. 180, p. 57.
30. Cowman M. K., Balazs E. A., Bergmann C. W. Meyer K. — Biochemistry (Wash.), 1981, vol. 20, p. 1379.
31. Curtis A. S. — Amer. Naturalist, 1960,vol. 94, p. 37.
32. Curtis A. S. — Biol. Rev., 1962, vol. 37.p. 82.
33. DeLuca S., Heinegard D.. Hascalt V. С.et al. — J. biol. Chem., 1977, vol. 252.p. 6600.
34. DeLuca S., Lohmander L S., Nilsson В. et al.— Ibid., 1980, vol. 255, p. 6077.
35. Deman J. J., Bruyneel E. A., Mareel M. M.—J. Cell Biol., 1974, vol. 60, p. 641.
36. Edwards A. W. — Nature, 1978. vol. 271.p. 248.
37. Franzen A., Inerat H., Hejderup S. 0 .Heinegard D. — Biochem. J., 1981.vol. 195.p. 335.
38. Gardell S., Baker J. Caterson В. —Biochem. biophys. Res. Commun., 1980. vol..95,p. 1823.
39. Gingell D. — J. theor. Biol. 1971, vol. 50.p. 121.
40. Goldstein I. J., Murphy L A., Ebisu S.-Pure appl. Chem., 1977, vol. 49, p. 1095.
41. Glimelius В., Norling В., Westermark B.,Wasteson A. — Biochem. J., 1979. vol. 172.p. 443.
42. Gregory J. D. — Ibid., 1973, vol. 133.p. 383.
43. Guss J. M., Hukins D. W., Smith P. J.et al.- J. molec. Biol., 1975, vol. 95,p. 359.
44. Hardingham T. — Biochem. Soc. Trans.,1981. vol. 9, p. 489. .
45. Hardingham T. — In: Proc. Eur. Symp.Connect. Tiss. Res. 7-th, 1980, p. 142.
46. Hardingham Т., Dunham D. G., Muir H. Biochem. Soc. Trans., 1980. vol. 9, p. 489.
47. Hardingham Т., Ewins R. J., Dunham D.,Muir H. — Seminars Arth. Rheum., 1981.vol. 11, N 1, Suppl. 1, p. 28.
48. Hardingham Т., Muir H. — Biochim:. biophys. Acta, 1972, vol. 279, p. 401.
49. Hardingham Т., Muir H.— Biochem. Soc.Trans., 1973, vol. 1. p. 282.
50. Hardingham Т., Muir H. — Biochein. J.,1973, vol. 135, p. 905.
51. Hascall.V. C. — J. Supramol. Struct, 1977,vol. 7, p. 101.
52. Hascall V. С., Sajdera S. W.— J. biol.Chem., 1977, vol. 244, p. 2384.
53. Hopwood J.J., Dorfman A. — Ibid., 1978,vol. 252, p. 4777.
54. Hopwood J. J., Dorfman A. — Pediat. Res.,1978, vol. 12, p. 52.
55. Isles M., Foweraker A. R., Jennings B. R. et al. —Biochem. J., 1978, vol. 173, p. 237.
56. Jones В. М. — Nature, 1966, vol. 212,p. 362.
57. Jones Dr. P.— Ibid., p. 365.
58. Kimura J. H.. Caputi С. В., Hascall V. C.—J. biol. Chem., 1980, vol. 255, p. 4368.
59. Kimura J. H., Hardingham T.Е. Hascall V. C. — Ibid., p. 7134.
60. Kimaia R.. Hascall V. C., Kimura J. H. —Ibid., 1982, vol. 257, p. 3827.
61. Launt T. C. — In: Chemistru and Molecular Biology of the Intercellular. Matrix/Ed.E. A. Balazs. New York, 1970, p. 703.
62. Laurent Т. C. — Upsala J. med. Sci., 1977,vol. 87, p. 90.
63. Lohmander L. S., DeLuca S., Nilsson B.et al. —J. biol. Chem., 1980, vol. 255,p. 6084.
64. Mason R. M., Kimura J. H., Hascall V. C.—Ibid., 1982, vol. 257, p. 2236.
65. McBrride W. H., Bard J. B. — J. exp. Med.,1979, vol. 149, p. 505.
66. Mathews М. B. — Nature, 1967, vol. 213,p. 1255.
67. Mathews M. B.t Decker T. — Biochim. biophys. Acta, 1977, vol. 498, p. 259.
68. Mathieson J. M., Pearce R. H. — Biochem.J.. 1977, vol. 161, p. 419.
69. McMurtrey J., Radhakrishnamurthy В, Dalferes R. — J. biol. Chem., 1979, vol. 254,p. 1621.
70. Merrillees M. J, Scott L. — Develop. Biol.,1980, vol. 76, p. 396.
71. Meyer K. — Cold. Spring. Harbor. Symp.Quant. Biol., 1938, vol. 6, p. 91.
72. Meyer K., Palmer J.-J. biol. Chem., 1934,vol. 107, p. 629.
73. Meyer K., Palmer J. — Ibid., 1936, vol. 114,p. 689.
74. Mikuni-Takagaki Y., Toole B. P. — Ibid.,1979. vol. 254, p. 8409.
75. Mitchell D. C., Hardigam T. E. — Biochem.J, 1981, vol. 196, p. 521.
76. Mitchell D. C.. Hardingham T. E. — Ibid.,1982. vol. 202, p. 249.
77. Morris J.E —Exp. Cell Res., 1979, vol. 120,p. 141.
78. Morris E. R., Rees D. A., Welsh E. J.J. molec. Biol., 1979, vol. 138, p. 383.
79. Norling В., Glimelius R., Westermark В.,Wastrson A. — Biochem. biophys. Res. Commun., 1978, vol. 84, p. 914.
80. Oegema T. R., Thompson K. C. — J. biol.Chem., 1981, vol. 256, p. 1015.
81. Oppenheimer S. B. — Amer. ZooL, 1978,vol. 18, p. 13.
82. Pennypacker J. P.. Goclinck P. F. — Develop. Biol., 1976, vol. 50, p. 35.
83. Pessac В., Dejendi V.— Science, 1972,vol. 175, p. 898.
84. Pethica B. A. — Exp. Cell Res., 1961, vol.8, Suppl., p. 123.
85. Pjeijle J., Hadmann W., Anderer A.—Biochim. biophys. Acta, 1981, vol. 670,p. 274.
86. Roth S. —Quart. Rev. Biol., 1973, vol. 48,p. 541.
87. Rollins B. J.. Gulp L. A. — Biochemistry (Wash.), 1979, vol. 18, p. 5621.
88. Roseman S.— Chem. Phys. Lipid., 1970,vol. 5, p. 270.
89. Rosen S. D., Kaur J., Clark D. L. et al.J. biol. Chem., 1979, vol. 254, p. 9408.
90. Sahu S., Lynn W. S. — Biochem. J.. 1978,vol. 173, p. 565.
91. Schwartz N. B. Ho P. L.. Dorjmar, A.Biochem. biophys. Res. Commun.. 1976,vol. 71, p. 851.
92. Scott J. E, Healley F. —Biochem. J. 1979,vol. 181, p. 445.
93. Scott J. E., Heatleu F.. MoorcrojtD.. Olavesen H. — Ibid.. 1981, vol. 199, p. S29.
94. Scot: J .E ., Orjord R.. Hughes E. —Ibid.,vol. 195. p. 573.
95. Scott J. E., Tigwell M. J.— Ibid 1978,vol. 173, p. 103.
96. Shimada E., Maisumura С —J. Biochem.(Tokyo), 1975. vol. 78, p. 513.
97. Solursh M., Vacrewyck S. A., Reiter R. S Develop. Biol., 1974, vol. 41, p. 233.
98. Solursh M., Hardingham Т.. Hascall V. C.,Kimura J.— Ibid.. 1980, vol. 75, p. 121.
99. Srvinasan S. R., Yost A., Radhakrishnamurthy B. et al.— Atherosclerosis. 1980,vol. 36, p. 25.
100. Stookwell R. A. Biology of Cartilage Cells.Cambridge, 1979.
101. Sugahara K., Schwartz N В., Dorjman A.—J. biol. Chem., 1979. vol. 254.p. 6252.
102. Tajiri K., Uehida N., Tanzer M.U. .— Ibid.,1980. vol. 255, p. 6036.
103. Tang L. H., Rosenberg L., Reiner R. J.,PooL- A. R. — Ibid., 1979, vol. 254,p. 10523.
104. Toole B. P. — In: Neuronal Recognation/Ed. H. Barondes. New-York, 1976.p. 275.
105. Torchia D. A., Hasson M .A., Hascall V. C. — J. biol. Chem.. 1981. vol. 256.p. 7129.
106. Turlley E.A., Roih S.— Nature. 1980,vol. 283. p. 268.
107. Umbreit J., Roseman S., — J. biol. Chem.,1975. vol. 250. p. 9360
108. Underhill C. B., Doriman A. — Exp. Cell Res., 1978. vol. 117, p. 155.
109. Ubderhill С. В., Toole В P. - J Cell Biol.1979, vol. 82, p. 475.
110. Underhill С. В., Toole B. P. — J biol.Chem., 1980, vol. 255. p. 4544.
111. Uzuka M., Nakajima K., Ohota. S., Mori J. — Biochim. biophys. Aeta, 1981,vol. 673, p. 387.
112. Wasteson A., Westermark В., Lindahl U.,Ponten J. — Int. J. Cancer, 1973, vol. 12,p. 169.
113. Weiss L. — Rev. Citol., 1960, vol. 9. p.187.
114. Weiss M. S. — Upsala J. med. Sci .,1977,vol. 82. p. 91.
115. Welsh E.J., Rees D. A., Morns E’. R.,Madden J. K. — J. molec. Biol., 1980,vol. 138, p. 375.
116. Wiebkin 0.W., Hardingham T. E.,Muir H. — ln: Extracellular Matrix Influences on Gene Expression Ed. H. C. Slavkin, R. C. Greulich. New York,1975, p. 209.
117 Wiebkin 0. W., Muir H. — Phil. Trans, roy.Soc. Lond., 1975, vol. 271, p. 283.
Используются технологии uCoz |